LES FORÊTS SONT-ELLES LE POUMON DE LA PLANÈTE ?
Académie de Stanislas
François Le Tacon
Introduction
L’expression Les forêts poumons de la terre est devenue familière et est constamment utilisée dans les médias depuis des décennies. Nous pouvons déjà relever une première contradiction. En effet les poumons des animaux absorbent de l’oxygène et rejettent du gaz carbonique alors que les arbres font l’inverse pendant la photosynthèse. Assimiler la forêt à un poumon est donc un contresens. Mais la question est de savoir si les arbres, et donc les forêts, participent actuellement à la production de l’oxygène que nous respirons. C’est à cette question très complexe que nous allons tenter de répondre.
L’atmosphère primitive de la terre
L’atmosphère primitive a été générée à partir des matières solides qui se sont agrégées au moment de la naissance de la terre il y a 5 milliards d’années et qui ont été portées à des températures élevées (3 800°C à 5 500°C dans le noyau suivant la profondeur). Pendant longtemps, il a été admis que les gaz volcaniques primitifs provenant de la matière en fusion étaient fortement réduits (hydrogène, méthane). Plus tard, les émissions volcaniques se seraient modifiées et seraient devenues proches des émissions actuelles, c’est-à-dire un mélange d’eau, de gaz carbonique, de monoxyde de carbone, d’azote et d’hydrogène sulfuré. Ce modèle est partiellement remis en question : au moment de la naissance de la vie, il y a 3850 millions d’années, l’atmosphère terrestre aurait pu être faiblement réduite avec principalement du gaz carbonique et de l’azote ainsi que des traces de monoxyde de carbone, d’hydrogène et d’hydrogène sulfuré. Malgré les incertitudes, un point fait consensus : l’atmosphère terrestre était dépourvue d’oxygène au moment de l’apparition de la vie.[1]
L’apparition de la vie
Il est généralement admis que la vie est née dans les océans, dont l’origine est la condensation de la vapeur d’eau de l’atmosphère primitive lorsque la température initiale est devenue suffisamment basse. Une atmosphère secondaire a alors remplacé la précédente (Kasting, 1993). Néanmoins, la température de la surface de la Terre était peut-être trop élevée pour permettre cette condensation. Selon Woese (1979), un métabolisme primitif aurait pu se produire à la surface des gouttelettes d’eau dans les nuages.
Cependant, la naissance dans les océans reste l’hypothèse privilégiée. Des organismes vivants primitifs, des progénotes, dérivés d’un ancêtre hypothétique, appelé LUCA pour Last Universal Cellular Ancestor, y seraient apparus il y a environ quatre milliards d’années ou en peu plus, en l’absence d’oxygène (Forterre et al., 1993). Dans des schistes du Groenland vieux de 3,7 milliards d’années, de la matière organique possède une signature isotopique 12C/13C identique à celle caractéristique des organismes vivants actuels. Le mode de fonctionnement de ces premiers organismes vivants, des procaryotes, aurait été de type saprotrophe par consommation d’une soupe riche en composés organiques. Ces composés organiques ne provenaient pas de la photosynthèse, qui était alors inconnue, mais de réactions chimiques dites abiotiques, c’est-à-dire s’effectuant sans êtres vivants. Selon une autre hypothèse, ces premiers être vivants auraient été lithotrophes ou chimiotrophes (Edwards, 1998). Autrement dit, l’énergie qui leur était nécessaire leur aurait été fournie par des composés minéraux comme l’hydrogène sulfuré ou le méthane.
Une autre question est aussi de savoir si, au moment de la naissance de la vie, la température était élevée (80°C à 100°C ou plus) ou au contraire beaucoup plus faible (20°C à 50°C). Cette question reste ouverte, même si l’hypothèse d’une température élevée est privilégiée.
L’apparition de l’oxygène dans l’atmosphère
La photosynthèse qui permet de fixer le gaz carbonique et de rejeter de l’oxygène date de 3,5 à 3,8 milliards d’années. Ce sont des cyanobactéries, autrement dit des procaryotes, qui ont pu accomplir cette tâche extraordinaire. Ces cyanobactéries phototrophes ont la propriété de fixer par photosynthèse le gaz carbonique de l’air en rejetant de l’oxygène grâce à des thylakoïdes et, pour certaines d’entre elles, de fixer l’azote de l’air N2 en le transformant en azote combiné (Figure 1).
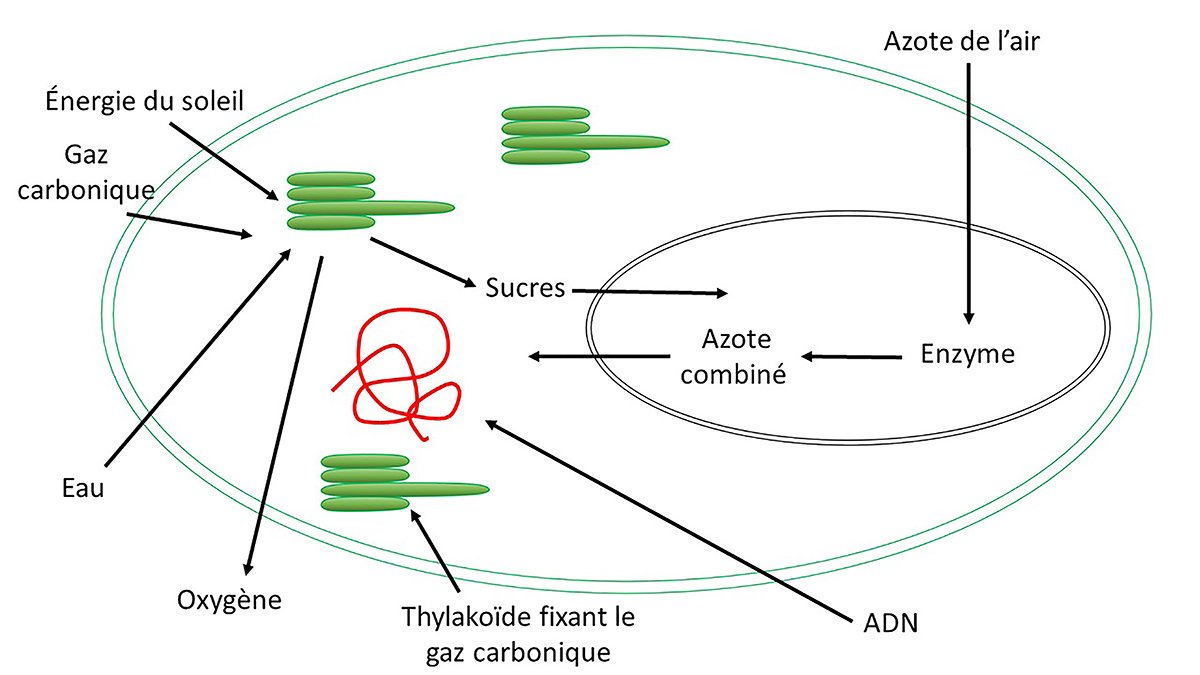
Figure 1. Représentation schématique du fonctionnement d’une cyanobactérie.
La photosynthèse s’est déroulée pendant très longtemps en conditions anoxiques. En effet, l’oxygène libéré était immédiatement utilisé pour oxyder les énormes quantités de fer ferreux Fe2+ou de fer natif (Fe0) présentes dans la croute terrestre. Le fer ferreux, ainsi que le fer natif éventuellement présent ont été oxydés en fer ferrique (Fe3+) sous la forme de magnétite et d’hématite. Cette oxydation a donné naissance aux gisements archéens de fer rubané qui représentent 90 % du minerai de fer exploité dans le monde.
L’oxygène a commencé à s’accumuler dans l’eau et l’atmosphère il y a deux ou trois milliards d’années, à partir du moment où il n’y avait plus de fer à oxyder. Les cyanobactéries phototrophes ont dû s’adapter à ces nouvelles conditions et mettre en place un système de protection contre l’oxygène qu’elles produisaient.
Les véritables eucaryotes à ADN nucléaire sont nés il y a 2,8 à 2,4 milliards d’années. Ils résultent de la symbiose entre des eucaryotes primitifs et des bactéries qui ont donné naissance aux mitochondries. Ces dernières sont des unités qui fabriquent l’énergie nécessaire au fonctionnement de la cellule. Elles possèdent encore des gènes, un métabolisme et des caractéristiques biochimiques proches de certaines bactéries libres. Plus tard, il y a peut-être deux milliards d’années, une nouvelle symbiose entre un eucaryote à mitochondries et des cyanobactéries a donné naissance à de nouveaux organismes disposant de thylakoïdes, inclus dans des chloroplastes et capables de photosynthèse. Ce sont les algues dont certaines ont gagné les eaux saumâtres, puis les eaux douces. Les ancêtres des végétaux terrestres pourraient être des charophytes, des algues dont certaines existent encore dans les eaux douces (McCourt, Delwiche, Karol, 2004). Les premiers végétaux terrestres ont rapidement pris de la hauteur jusqu’à former des forêts primitives au Dévonien vers – 400 millions d’années (Berry et Marshall, 2015) (Figure 2).
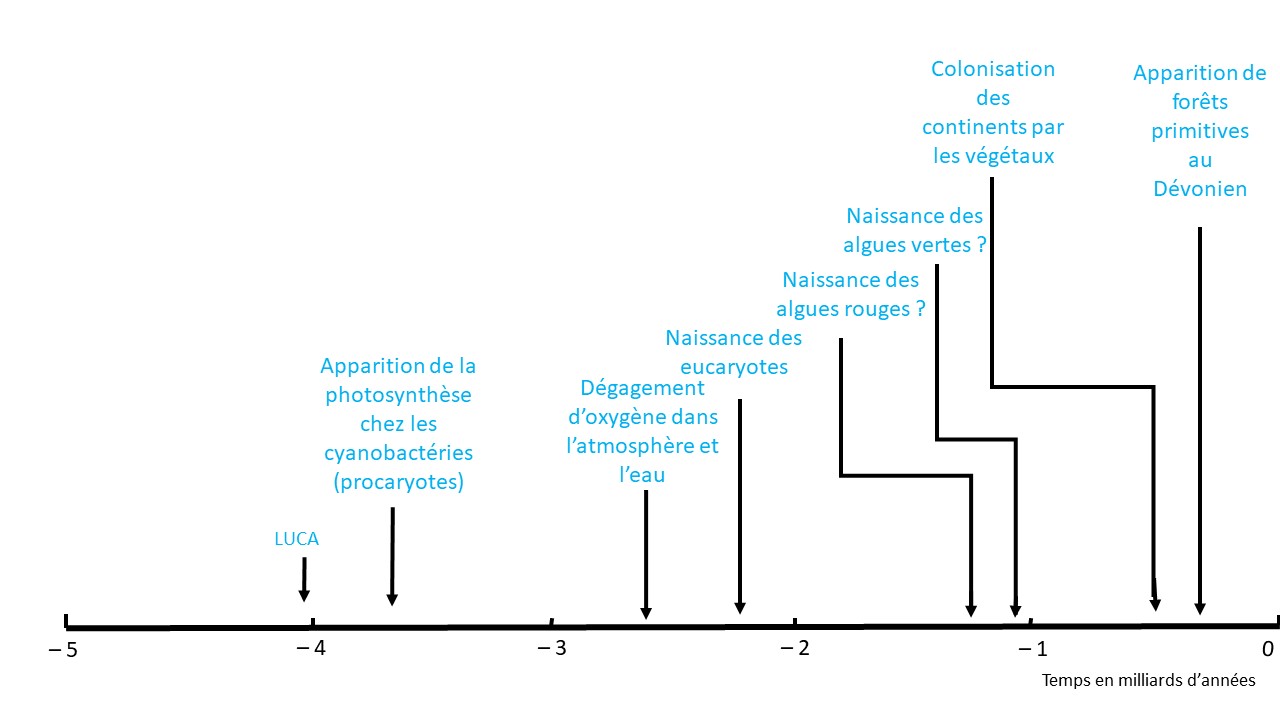
Figure 2. Chronologie des principaux évènements depuis la naissance de la vie jusqu’à l’apparition des forêts.
Cette énorme masse végétale, marine et terrestre, a photosynthétisé des quantités phénoménales de carbone, rapidement recyclées par les champignons et les bactéries. Mais une partie n’a pas été recyclée et s’est accumulée sous formes diverses dans les sédiments. L’absence de recyclage de ce carbone a provoqué une accumulation d’oxygène dans l’atmosphère, oxygène qui s’est ajouté à celui initialement produit par les cyanobactéries (Figure 3).
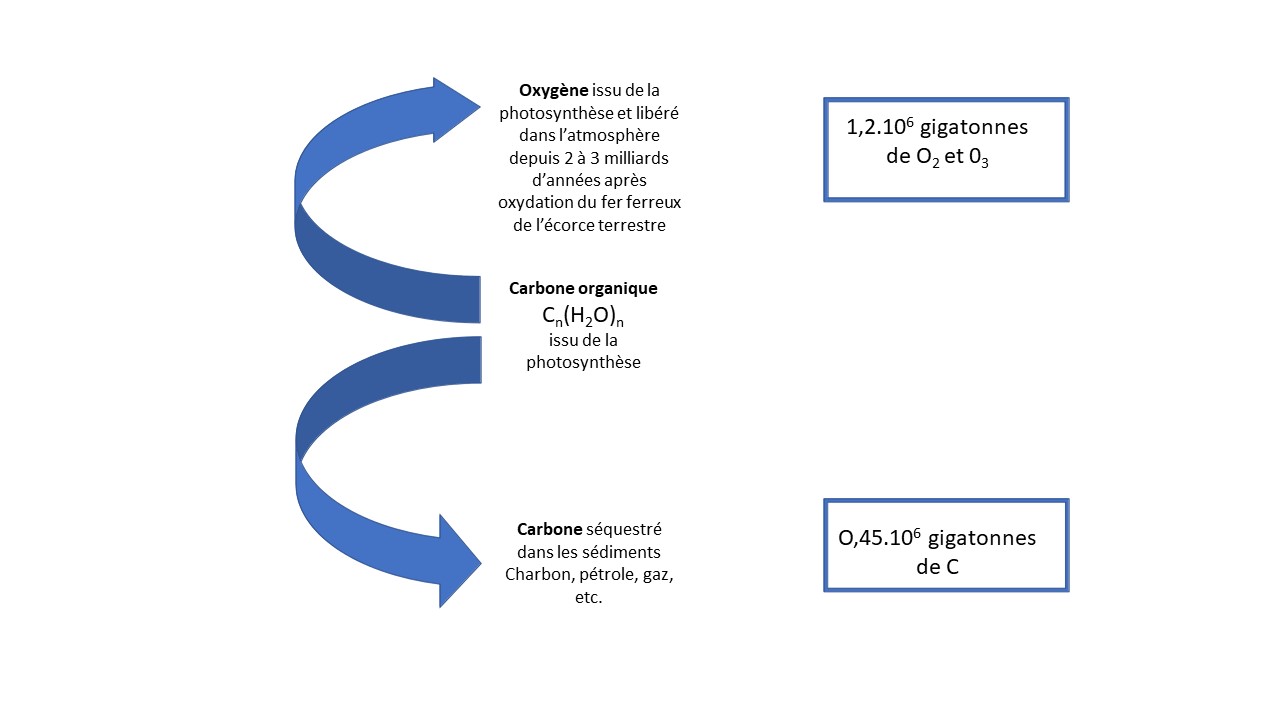
Actuellement l’oxygène représente 23,1% de la masse atmosphérique, sous forme de dioxygène O2 et d’ozone O3, soit 1,2.106 gigatonnes environ, ce qui correspond à 0,45.106 gigatonnes de carbone fixé dans les sédiments. Il faut ajouter à cela le carbone photosynthétisé en conditions anoxiques et dont il est difficile d’estimer la masse.
Figure 3. Cycle ouvert du carbone et de l’oxygène à l’échelle des temps géologiques. Ce schéma ne prend pas en compte l’oxygène ayant servi à oxyder le fer ferreux de la croute terrestre. Il est vraisemblablement équivalent à celui de l’atmosphère actuel ou supérieur. Le carbone fixé dans les sédiments pourrait donc être très supérieur à 0,45.106 gigatonnes. De même, ce schéma ne prend pas en compte l’oxygène dissous dans l’eau des océans ou des eaux douces. Cet oxygène ne représente cependant qu’un faible pourcentage de l’oxygène atmosphérique. Depuis que l’homme utilise une partie du carbone fossile pour ses besoins énergétiques, ce cycle ouvert se referme partiellement, ce qui ne modifie pas significativement le stock d‘oxygène de l’atmosphère, ni celui du carbone des sédiments.
Un bilan carbone/oxygène dynamique
Nous ne devons pas raisonner uniquement en termes de stock ou de réservoir de carbone ou d’oxygène, mais en termes de dynamique. Le carbone organique résultant de la photosynthèse retourne en effet plus ou moins rapidement à l’état de gaz carbonique depuis que les conditions sont devenues oxygéniques. Le recyclage du carbone est assuré par la respiration de tous les êtres vivants qui consomment directement ou indirectement celui fixé par la photosynthèse. La combustion lors des incendies naturels et maintenant la combustion résultant de l’activité humaine contribuent également à ce recyclage. L’état du carbone alternativement organique ou minéral s’inscrit dans deux cycles biogéochimiques couplés, celui du carbone et celui de l’oxygène (Figure 4).
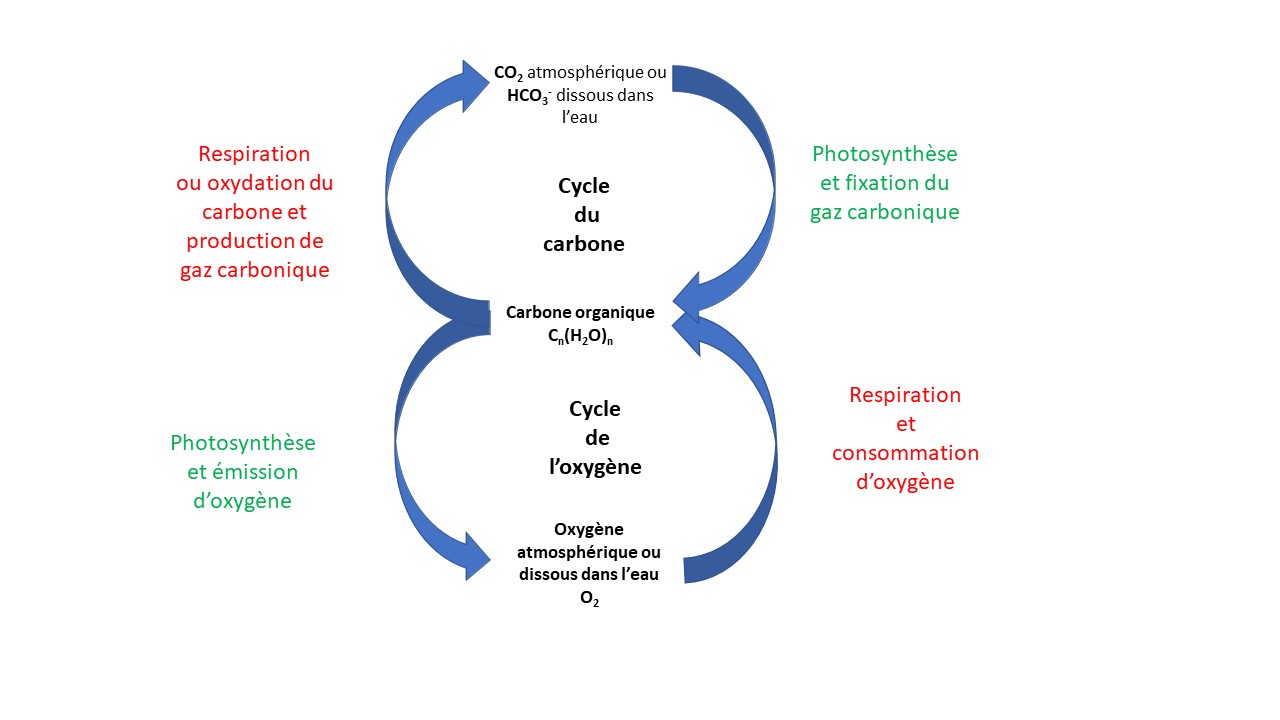
Figure 4. Cycles couplés du carbone et de l’oxygène.
La production primaire nette des écosystèmes terrestres est d’environ 60 gigatonnes de carbone par an, contre 40 gigatonnes pour les océans. Or, les réserves atmosphériques de carbone sous forme de CO2 ne sont que de 750 gigatonnes. Autrement dit, si ce carbone n’était pas recyclé, la photosynthèse s’arrêterait au bout d’environ sept ans par manque de CO2 et probablement avant en raison d’un brutal refroidissement de la surface de la planète sous l’effet de la disparition de l’effet de serre.
Inversement, les besoins en oxygène pour le retour du carbone organique à l’état de CO2 sont annuellement de 266 gigatonnes, ce qui est totalement négligeable par rapport à la quantité d’oxygène atmosphérique (1,2.106 gigatonnes). En conséquence, la teneur en oxygène de l’atmosphère reste invariable, alors que la teneur en CO2 augmente depuis l’ère industrielle (416 ppm actuellement contre 278 avant l’ère industrielle). La teneur en CO2 de l’atmosphère oscille aussi pendant l’année. Elle baisse quand la végétation de l’hémisphère nord photosynthétise, c’est-à-dire pendant l’été boréal, puis augmente à nouveau pendant l’hiver et ainsi de suite.
Ce cycle du carbone et de l’oxygène doit donc être équilibré à un epsilon près afin qu’il puisse fonctionner sur une longue période. La fixation du carbone par photosynthèse doit être compensée quasi totalement par la respiration de tous les êtres vivants. Les écosystèmes marins ou terrestres actuels, dont les forêts, ne produisent donc pas d’oxygène, même si quelques nuances sont à apporter.
Le bilan carbone/oxygène dans les différents types de forêt
Comme nous l’avons souligné, dans tous les écosystèmes, qu’ils soient marins ou terrestres, la fixation du gaz carbonique par photosynthèse est égale au rejet de ce même gaz par la respiration de l’ensemble des êtres vivants qui les composent, moins la très faible quantité de carbone qui est fixée dans les sédiments (Figure 4).
Dans les écosystèmes forestiers, la situation est assez complexe à des échelles de temps courts et dépend du degré d’exploitation du bois par l’homme.
Dans les forêts primaires stables, la fixation du gaz carbonique par photosynthèse est égale au rejet par respiration (Kira et Sihdei, 1967 ; Odum, 1969). Ces forêts rejettent par conséquent autant de gaz carbonique qu’elles n’en fixent. Cependant, l‘équilibre est très long à s’établir. Selon Luyssaert et al. (2008), certaines forêts primaires boréales ou tempérées peuvent continuer à accumuler du carbone pendant plusieurs siècles, en particulier dans les sols sous forme de matière organique très stable, et pourraient donc continuer à émettre plus d’oxygène qu’elles n’en consomment pendant très longtemps avant que le point d’équilibre ne soit atteint, s’il est vraiment atteint. D’autre part, le bilan n’est pas nul comme dans tout écosystème et une fraction minime de la matière organique entraînée hors de l’écosystème par les eaux ne retourne jamais in situ à l’état de gaz carbonique et est en partie définitivement séquestrée dans les sédiments en devenant du carbone fossile.
Dans les forêts exploitées pour leur bois, lorsque les arbres sont récoltés, une partie de la biomasse est transformée en produits manufacturés tels que charpentes, solives, fenêtres, cloisons, meubles et papier. Ces produits forestiers ont une demi-vie de séquestration du carbone allant de seulement 4 ans pour le papier à 65 ans pour les matériaux de construction et les meubles avec des écarts très importants selon les conditions de conservation. (Pussinen et al., 1997). Des charpentes, et en particulier celles des cathédrales gothiques, peuvent durer plusieurs siècles. Des sarcophages égyptiens en bois peuvent avoir plusieurs millénaires. Ce bois récolté et conservé sur une période plus ou moins longue se traduit par un faible gain d’oxygène correspondant.
Dans les plantations, le bilan de carbone évolue avec le temps. Planter des arbres sur des sols anciennement cultivés[2] augmente le carbone séquestré dans les sols et dans la biomasse qui continue à s’accumuler dans les parties aériennes et les racines pendant des années ou des dizaines d’années. Le bilan de fixation du gaz carbonique est donc positif pendant la croissance des arbres tout en se rapprochant de l’équilibre lorsque les plantations sont maintenues pendant longtemps. Mais les plantations sont faites le plus souvent pour être exploitées ; au moment de la récolte, et surtout après coupe rase, une bonne partie du carbone séquestré dans la partie aérienne et non récolté ou dans la matière organique des sols retourne dans l’atmosphère sous forme de gaz carbonique, ce qui entraîne une consommation d’oxygène équivalente à celle émise pendant la phase d’accumulation de biomasse[3].
Dans les plantations à très courte (5 ans) ou courte révolution (10 à 20 ans), l’accumulation de carbone, puis le déstockage au moment de l’exploitation s’enchaînent rapidement. Lorsque la révolution est plus longue, 40 à 120 ans, l’intervalle entre période d’accumulation et déstockage augmente.
Au niveau de la planète, les quatre milliards d’hectares de forêt stockent dans leurs sols et leur biomasse environ 1 240 gigatonnes de carbone, dont 37 % en forêts tropicales ou subtropicales, 14% en forêts tempérées et 49% en forêts boréales (Dixon et al., 1994). Ce carbone stocké dans la biomasse forestière correspond à la libération de 3 298 gigatonnes d’oxygène dans l’atmosphère. Si cette biomasse est détruite par déforestation, son carbone est oxydé et retourne dans l’atmosphère sous forme de gaz carbonique.
Toujours au niveau de la planète, la quantité de carbone fixé par la photosynthèse et entrainé vers les océans par l’ensemble des fleuves et rivières est estimée annuellement à 370 millions de tonnes de carbone (Schlesinger et Melak, 1981), ce qui correspondrait, s’il était définitivement fossilisé, à un gain annuel de 980 millions de tonnes de O2 atmosphérique, (0,0098 gigatonnes), ce qui totalement négligeable en comparaison de la masse d’oxygène atmosphérique. En outre, une partie de cette matière organique est minéralisée par la microfaune ou microflore marine et n’est pas fossilisée.
Conclusions
A l’échelle des temps géologiques, les cycles du carbone et de l’oxygène sont ouverts en raison de la séquestration d’une partie du carbone dans les sédiments, ce qui explique l’accumulation d’oxygène dans l’atmosphère depuis 2 ou 3 milliards d’années avec l’apparition de la photosynthèse chez les cyanobactéries et l’oxydation complète du fer ferreux de l’écorce terrestre.
Actuellement, l’ensemble des écosystèmes marins ou terrestres ne produisent pas d’oxygène puisque la quantité de cet élément libéré par photosynthèse est égale à la quantité nécessaire à la respiration de l’ensemble des êtres vivants au terme de deux cycles couplés. Ces deux cycles doivent être en équilibre pour se perpétuer sous peine d’entrainer en quelques années l’arrêt de la photosynthèse par manque de gaz carbonique.
Le bilan carbone/oxygène des forêts primaires non exploitées est équilibré même si certaines forêts primaires boréales ou tempérées peuvent continuer à accumuler du carbone pendant plusieurs siècles.
Dans les forêts exploitées pour leur bois ou les plantations le bilan carbone/oxygène évolue avec le temps. Dans les plantations, il y a d’abord accumulation de biomasse et rejet d’oxygène. En fin de révolution, au moment de l’exploitation finale, le bilan carbone/oxygène s’inverse et quand tout le bois exploité a été minéralisé le bilan est nul.
En définitive, quels que soient leurs types, primaires, exploitées ou plantées, les forêts ne jouent pas de rôle dans la production d’oxygène de la planète en raison de la masse considérable de cet élément dans l’atmosphère et du recyclage continu de la matière organique photosynthétisée. Comme nous l’avons déjà évoqué, sans ce recyclage, le CO2 de l’atmosphère, dont la masse est au contraire très limitée par rapport à celle de l’oxygène, disparaîtrait en quelques années et la vie s’arrêterait sur terre.
Si les forêts n’interviennent pas significativement dans l’évolution du stock d’oxygène de l’atmosphère, leur rôle n’en est pas moins essentiel dans le fonctionnement de l’écosystème terre : stockage du carbone, participation au cycle de l’eau, influence sur le climat, protection des sols, maintien de la biodiversité, etc.
Glossaire
Acide aminé : acide organique possédant un groupement azoté (amine). Les acides aminés sont les constituants des protéines.
Anoxique : privé d’oxygène.
Archéen ou Archéozoïque ou Précambrien : période précédant l’ère primaire ou Paléozoïque, de la naissance de la Terre à – 540 millions d’années.
Chloroplaste : organite des cellules des organismes eucaryotes phototrophes. Les chloroplastes sont le résultat d’une symbiose entre un eucaryote non phototrophe et une cyanobactérie.
Cyanobactéries : bactéries capables de fixer le gaz carbonique et pour certaines d’entre elles l’azote de l’air. Elles sont à l’origine des stromatolithes qui sont essentiellement formées de calcaire.
Dévonien : Étage du Paléozoïque de – 416 à – 359 millions d’années.
Eucaryotes : êtres dont l’ADN est contenu dans un noyau.
Gigatonne ou Gt : 109 tonnes ou un milliard de tonnes.
Hématite : oxyde de fer de formule Fe2O3.
Magnétite : oxyde de fer de formule Fe3O4.
Mitochondrie : organite des cellules eucaryotes dont l’origine est procaryote. Les mitochondries sont le siège de nombreux processus métaboliques énergétiques.
Oxydation : réaction chimique aboutissant à l’association d’un élément ou d’une molécule à l’oxygène. Cette réaction se traduit par une perte d’électron. La réaction inverse, c’est-à-dire la réduction, se traduit par un gain d’électron.
Oxydé : qui a subi une oxydation
Ozone ou trioxygène : molécule instable formée de trois atomes d’oxygène
Photosynthèse : processus biologique permettant aux plantes et à certaines bactéries de synthétiser de la matière organique à partir de l’eau et du gaz carbonique de l’air en utilisant l’énergie solaire. Par ce processus, le carbone est réduit.
Phototrophe ou photosynthétique : qui tire son énergie de la lumière par photosynthèse.
ppm : partie par million.
Procaryotes : êtres dont l’ADN n’est pas contenu dans un noyau.
Progénote : cellule hypothétique primitive d’où seraient issus tous les êtres vivants. Pourrait être assimilé à LUCA.
Réduction : dissociation d’un élément ou d’une molécule avec l’oxygène ; se traduit par un gain d’électron.
Réduit : qui a subi une réduction.
Respiration : processus biologique d’oxydation du carbone organique en CO2 et fournissant de l’énergie aux êtres vivants.
Saprophyte ou saprotrophe : qui se nourrit de la matière organique morte.
Symbiose : association à bénéfice réciproque entre deux organismes différents.
Thylakoïde : organe lamellaire, contenant de la chlorophylle, où a lieu la photosynthèse chez les cyanophycées. Chez les végétaux, les thylakoïdes issus d’une symbiose avec une cyanophycée sont situés dans les chloroplastes.
Références non exhaustives
Berner R. A., 1991. A model for atmospheric CO2 over Phanerozoic time, Amer. J. 291 339-376.
Berry C.M., Marshall J.E.A., 2015. Lycopsid forests in the early Devonian paleoequatorial zone of Svalbard. Geology, 43, 12, 1043-1046.
Dixon R.K., Solomon A.M., Brown S., Houghton R.A., Trexier M.C., Wisniewski J. 1994. Carbon Pools and Flux of Global Forest Ecosystems. Science, 263, 5144, 185-190.
Edwards M. R., 1998. From a soup or a seed? Pyritic metabolitic complexes on the origin of life, TREE 13, 178-181.
Forterre P., Benachenhou-Lahfa N., Confalonieri F., Duguet M., Elie C., Ladeban B., 1993. The nature of the last universal ancestor and the root of the tree of life, still open questions, BioSystems, 28, 15-32.
Holland H. D., 1997. Evidence for life on Earth more than 3850 million years ago, Science, 275, 38-39.
Houghton, R.A. 1999.The annual net flux of carbon to the atmosphere from changes in land use 1850-1990. Tellus 51B,298-313.
Houghton R.A., 2010. How well do we know the flux of CO2 from land-use change? Tellus, 62B, 557-351.
Jenny J.-P., Koiral S., Gregory-Eaves I., Francus P., Niemann C., AAhrens B., Brokvin V., Baud A., Ojala A. E. K., Normandeau A., Zolitschka B., and Carvalhais N. 2019. Human and climate global-scale imprint on sediment transfer during the Holocene. PNAS, 116, 46, 22972-22976.
Kasting J. F., 1993. Earth’s Early Atmosphere. Science, 259, 5097, 920-926
Kira T. and Sihdei T., 1967. Primary production and turnover of organic matter in different forest ecosystems of the western pacific. Jpn. J. Ecol. 17, 70–87.
Le Quéré C. et al., 2016. Global Carbon Budget 2016, Earth Syst. Sci. Data, 8, 605–649.
Le Tacon F., 2021. La déforestation, essai sur un problème planétaire. Éditions Quae.
Luyssaert S., Schulze E., Börner A. et al. 2008. Old-growth forests as global carbon sinks. Nature, 455, 213–215.
Maden B.E.H., 1995. No soup for starters? Autotrophy and the origins of the metabolism, Trends in Biochemical Sciences, 20, 337-341.
McCourt R.M., Delwiche C.F., Karol K.G., 2004. Charophyte algae and land plant origins. Trends in Ecology and Evolution, 19, 12, 661-666.
Miller S. L., 1993. A production of amino acids under possible primitive Earth conditions, Science, 117, 528-529.
Odum E. P., 1969. The strategy of ecosystem development. Science 164, 262–270.
Oki T. and Kanae S., 2006. Global Hydrological Cycles and World Water Resources. Science 25, 313, 5790, 1068-1072.
Oro J., 1961. Comets and the formation of biochemical compounds on the primitive Earth, Nature, 190, 389.
Pussinen A., Karjalainen T., Kellomäki S., R. Mäkipää R., 1997. Potential contribution of the forest sector to carbon sequestration in Finland. Biomass and Bioenergy, 13, 6, 377-387.
Schlesinger W.H., Melak M., 1981. Transport of organic carbon in the world’s rivers. Tellus, 33,2,172-187.
Wächtershäuser G., 1992. Groundworks for an evolutionary biochemistry: the iron-sulphur world. Progress on Biophysics and Molecular Biology, 58, 85-201.
Woese C.R.,1979. A proposal concerning the origin of life on the planet earth. Journal of Molecular Evolution, 13, 95-101.
Woodwell G.M., Hobbie J.E., Houghton R.A., Melillo J.M., Moore B., Peterson B.J., Shaver G.R., 1983. Global Deforestation: Contribution to Atmospheric Carbon Dioxide. Science, 222, 4628, 1081-1086.
[1] L’oxygène est le troisième élément le plus abondant dans l’univers après l’hydrogène et l’hélium, et l’élément le plus abondant de l’écorce terrestre. Son absence dans l’atmosphère primitive s’explique par son affinité à former des oxydes stables avec la plupart des autres éléments.
[2] Cela est un peu moins vrai pour le boisement des prairies dont les sols sont plus riches en matière organique que les sols travaillés tous les ans.
[3] Dans le cas des plantations d’eucalyptus en taillis à courte rotation, 7 ans par exemple, on exploite un septième de la surface chaque année. Les rejets issus des souches se développent vigoureusement quasi immédiatement dans les parcelles exploitées. On obtient ainsi un système stable de séquestration du carbone ne présentant pas les à-coups inhérents aux plantations à révolution plus longue.